Paciente de 58 años que acude a urgencias con pérdida de conciencia y que, según un familiar, se quejaba de una cefalea «muy insoportable», de inicio súbito y que comenzó hace 20 minutos aproximadamente.
TA 175/100; FC 105; Sat 02 96%.
Se realiza TC de cráneo sin contraste, objetivándose:

Se decide realizar Angio-TC.


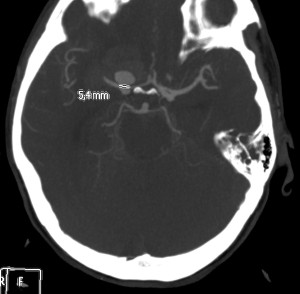

Estamos ante una Hemorragia Subaracnoidea por rotura aneurismática.
HEMORRAGIA SUBARACNOIDEA (HSA).
Es un subtipo de hemorragia intraparenquimatosa, indica la presencia de sangre dentro del espacio subaracnoideo. Recordemos algo de anatomía:
EPIDEMIOLOGÍA:
Aunque constituye solo el 3% de los ACV, es responsable del 5% de las muertes por ACV. La hemorragía subaracnoidea (HSA) se da con mayor frecuencia en personas de mediana edad, menores de 60 años, sobre todo en mujeres y en la raza negra. En Japón y Finlandia se han encontrado altos índices de incidencia. Tiene una importante carga genética y es más frecuente en pacientes con enfermedades del tejido conectivo: Poliquistosis Renal Autosómica Dominante (ADPKD), Neurofibromatosis tipo I, Elhers-Danlos tipo IV. Como factores de riesgo modificables están la hipertensión , el tabaco y la alta ingesta de alcohol.
Un tercio de los pacientes que sobreviven a una HSA serán dependientes para la actividades básicas de la vida diaria (ABVD) y de los que se consideran independientes para ellas, la mayoría sufrirán una disminución importante de su calidad de vida.
CLÍNICA:
Cefalea súbita, se desarrolla en segundos. Los pacientes la describen como «la peor cefalea de sus vidas». Puede asociar déficits neurológicos, fotofobia, meningismo, estados confusionales y pérdida de conciencia. Mencionar también que puede darse sin cefalea o que el resto de síntomas prevalezcan sobre ella o que suceda la ruptura en el contexto de un TCE, lo cual dificulta el diagnóstico.
También pueden acontecer epilepsias, por ello es importante tener una alta sospecha clínica de HSA en pacientes jóvenes con epilepsia de novo y cefalea post ictal inusualmente severa.
El traumatismo y el sangrado espontáneo son circunstancias significativas, por ello hay que tener alta sospecha diagnóstica en accidentados de tráfico, actividades deportivas y esfuerzos vigorosos, sobre todo ante la presencia de cefalea desproporcionada o rigidez cervical.
CAUSAS DE HSA
- Aneurisma roto – 85%.
- Hemorragia perimesencefálica (PMSAH) – 10%.
- Causas raras – 5%
- Malformación arterio-venosa (MAV)
- Fistula arterio-venosa dural (FAVD)
- MAV espinal
- Infarto venoso
- Disección arterial.
- Apoplejía hipofisaria
- Cocaina.
- Trauma (sin contusión).
RADIODIAGNÓSTICO. Escáner Cerebral (TC y RM):

J. Vivancos et al.
Aunque la RM tiene mayor sensibilidad para el diagnóstico de sangrado, es la TC la prueba de primera línea debido a su mayor disponibilidad. Observaremos la característica imagen de hiperdensidad en las cisternas basales que corresponde a la sangre extravasada. La mayoría de las veces veremos el característico aumento de densidad alrededor del polígono de Willis (65%), que es donde ocurren la mayoría de las roturas de aneurismas, y también en la región de la cisura de Silvio (30%). Podemos ver también sangre en la fosa interpeduncular o asta occipital de los ventrículos laterales.
La sensibilidad de la TC para el diagnóstico de HSA está fuertemente influenciada por la cantidad de sangre extravasada así como del tiempo transcurrido desde la hemorragia. Es importante destacar que aunque no se observen signos de sangrado en la TC, no podemos descartar la existencia de una HSA en pacientes con clínica compatible. A pesar de realizar el estudio dentro de las primeras 12 horas y con un equipo moderno de TC, los estudios son negativos en el 2% de los pacientes con HSA.
La TC ayuda a distinguir la ruptura aneursimática espontánea del sangrado tras traumatismo. Si la causa es un trauma, veremos el sangrado subaracnoideo confinado a los surcos superficiales de la convexidad del cerebro adyacente a la zona de fractura o contusión parenquimatosa. No obstante, si el traumatismo es en la región frontal, podemos ver sangre que simula una ruptura de aneurisma de la arteria cerebral anterior y cuando hay sangre en la cisura de Silvio o Ambiens, puede ser difícil distinguir entre traumatismo y aneurisma roto. Si el traumatismo es sobre el cuello, puede originarse un sangrado masivo que afecte las cisternas basares por afectación de las arterias de la circulación posterior.
La RM, al igual que la TC, detecta de manera muy fiable la sangre extravasada en la fase aguda(<12h) como hiperintensidad en el espacio subaracnoideo en secuencias FLAIR. Sin embargo, la menor disponibilidad y las características del estudio por RM (mayor duración del estudio y necesidad de anestesia en pacientes inquietos, por ejemplo) hacen que no se use como primera línea de diagnóstico. Sí adquiere mayor valor a partir de los 40 días para la detección de sangre en pacientes con TC negativo y punción lumbar positiva o paciente con clínica atípica que consultan al médico hasta 2 semanas después del comienzo del cuadro.
Punción Lumbar: Merece mención especial, ya que en nuestros días sigue siendo una prueba indispensable para aquellos pacientes con historia típica de HSA y Escáner cerebral negativo. Debe realizarse preferiblemente tras haber transcurrido 12 horas desde el inicio de la clínica. Durante este periodo ocurrirá la lisis y degradación de los hematies. La presencia de pigmentos que surgen de los productos de degradación (oxyhemogloina y bilirrubina) de los hematíes, teñirán el líquido cefaloraquídeo tras centrifugación de un color color amarillo caracterísitco. Es lo que denominamos Xantocromía. Para evitar falsos positivos y diferenciar la xantrocromía de una punción traumática, lo idel sería realizar una espectrofotometría en el laboratorio lo más rápidamente posible.
ANEURISMAS SACULARES. Principal causa de HSA:
El 85% de las hemorragias espontáneas en el espacio subaracnoideo son debidas a la ruptura de un aneurisma. Se deben a la evaginación de la íntima y la adventicia, la clave es la ausencia de lámina elástica interna y capa muscular. Se da en el 1% de la población y entre el 2-30% pueden ser múltiples. El 90% de los aneurismas cerebrales se localizan en la circulación anterior, los localizados en la ACM dan la típica imagen de hiperdensidad en las cisternas basares cuando se rompen.
Aunque no son congénitos, los aneurismas se desarrollan con la edad, sobre todo en pacientes con poliquistosis renal AD, predisposición familiar o arteriosclerosis. Son muy raros en neonatos y en la infancia, en caso de haberlos, la causa subyacente suele ser el desarrollo tras un trauma, infección o conectivopatías. Entre los factores de riesgo destacamos el alcohol, el tabaco y la hipertensión, que producen cambios adquiridos en la íntima de la pared arterial. Otras entidades que pueden favorecer la formación de aneurismas son las neoplasias, como los hemangioblastomas o las metástasis de los carcinomas bronquiales, y las causas yatrogénicas, como la radioterapia o post intervenciones quirúrgicas vaculares en las zonas de anastomosis (arteria temporal superficial-bypass arteria cerebral media).
Búsqueda de Aneurismas.
Angiografía: El gold estándar para la búsqueda de aneurismas es la angiografía convencional, sin embargo es un procedimiento que consume tiempo, no está excento de complicaciones e incluso puede ocurrir la re-ruptura del aneurisma. Dentro de las primeras 6 horas, se estima que el 5% de los aneurismas puede sufrir una re-ruptura.
Angiografía – RM: También es útil para valorar la existencia de un aneurisma causante de HSA. S: 70-97%; E: 75 – 100%. Aunque a favor tiene que es una prueba no invasiva, sin embargo, dada la menor disponibilidad y el contexto crítico de los pacientes, se utiliza menos que la angio-TC.
Angiografía- TC: Se basa en la TC de cortes helicoidales. Aunque implica radiación para el paciente y requiere administración de contraste iodado intra-venoso (no requiere cateterización arterial), el hecho de que posea gran disponibilidad y sea una técnica rápida y fácil de llevar a cabo en pacientes enfermos, hace que se use como prueba de primera línea. Se puede realizar con cortes de 1 mm y realizaremos reconstrucciones para obtener imágenes como las de una angiografía (cine + MIP).
POLÍGONO DE WILLIS
-Indicaciones: HSA con patrón aneurismático (cisterna supraselar)
-Contraste: 50 ml (Standard).
-F view: C4 – 2/3 craneales.
-Localizador: C4
-ROI: carótida (o fuera). Mirad la carótida contralateral para no confundir con yugular.
OTRAS CAUSAS DE HSA:
Del 15% de causas de HSA no atribuibles a rotura aneurismática, el 10% corresponden a hemorragia perimesencefálica y el 5% restante se debe a causas más raras.
Hemorragía perimesencefálica – 10%: Es la hemorragia que queda confinada a las cisternas próximas al mesencéfalo y el sangrado central está inmediatamente anterior a dicha estructura, aunque también puede encontrarse signos de sangrado cercanas a protuberancia, cisternas ambiens y cuadrigéminas. No hay extravasación a cisura de silvio ni a la interhemisférica en su porción anterior. Puede haber sedimento de sangre en el asta posterior de los ventrículos laterales pudiendo producir su ensanchamiento.
En 95% pacientes con una hemorragía perimesencefálica no se encuentra punto de sangrado, se piensa que puede ser venoso. Entre el 2 y 5% de los pacientes puede ser causada por una rotura de un aneurisma de la fosa posterior, un angio-TC es conveniente para descartarlo.
Suele ocurrir en pacientes en la sexta década de la vida (como la HSA aneurismática), aunque puede darse en jóvenes de 20 años, con antecedentes de hipertensión o actividad extenuante que precede al inicio de los síntomas. La cefalea parece tener un inicio más gradual; la pérdida de consciencia y la focalidad neurológica suelen ser más excepcionales. Son paciente con buena condición clínica, aparte de su dolor de cabeza, y suele cursar sin incidentes (el resangrado y la isquemia tardía no ocurren). El tratamiento y su pronóstico son mucho mejores que en la HSA aneurismática.
PACIENTES SIN CAUSA JUSTIFICABLE:
Si la angiografía no detecta causa responsable de la HSA, hay que tener en cuenta el patrón del sangrado. Si el sangrado es perimesencefálico, el diagnóstico de HSA de etiología NO aneurismática se establece y ninguna prueba más es requerida dado el buen pronóstico del caso.
Pacientes con un patrón de HSA por rotura de aneurisma y con angiografía negativa, tienen un 10% de riesgo de isquemia y resangrado. Se deben ingresar en UCI o unidad de cuidados especializada y proceder con el algoritmo diagnóstico.
Debido al riesgo de resangrado, se indican los TC de control en pacientes con HSA aneurismática. Además, la realización de un Segundo y Tercer angio TC en pacientes con patrón aneurismático, ha permitido la detección de aneurismas que se habían pasado por alto.
Algoritmo.
COMPLICACIONES:
J. Vivancos et al.
Resangrado: Ocurre entre el 8 – 23% de los pacientes, el riesgo es mayor en las primeras 24 horas tras la HSA, particularmente las 6 primeras. El riesgo es mayor si hay alta escala de Hunt & Hess en la admisiónl, a mayor diámetro del aneurisma, alta presión arterial, cefalea centinela precediendo la HSA, largo intervalo desde el incio del ictus hasta la adimisión o ventriculostomía temprana.
Suele producirse como un deterioro neurológico, evidenciándose un sangrado en el TC cerebral. La punción lumbar es difícil de evaluar ya que la xantocromía persiste unas 2 semanas o más. La mortalidad alcanza el 70% y solo el tratamiento del aneurisma previene su aparición.
Vasoespasmo e isquemia cerebral tardía (ICT): Aunque puede ser silente, la isquemia se manifiesta típicamente como deterioro neurológico focal o pérdida de conciencia y es una complicación frecuente, siendo responsable de gran parte de la morbimortalidad de la HSA. En el 40-60% de los casos podremos encontrar evidencias de isquemia cerebral tardía, manifestándose sobre todo como infartos aislados corticales cercanos a la zona de ruptura del aneurisma o infartos múltiples disperos, bilaterales y subcorticales, localizados distales al aneurisma roto; viéndose en el 40 y 50% de los casos respectivamente. Pacientes jóvenes de <55 años y fumadores tienen más riesgo.
La etiología principal de la ICT es el vasoespasmo. La severidad depende de la arteria afectada y del grado de circulación colateral. El vasoespasmo suele producirse tres días después de la hemorragia, produciéndose un pico de incidencia sobre el día 7-8. Se cree que el vasoespasmo es debibo a sustancias espasmogénicas que se generan durante la lisis de la sangre subaracnoidea.
Factores de riesgo son la severidad del sangrado y la proximidad a los vasos mayores. En TC, coágulos de sangre mayores de 3 x 5 mm y capas de sangre de más de 1 mm de grosor son buenos predictores de vasoespasmo. La escala Fisher (ver más abajo) nos permite predecir el riesgo de vasoespasmo y de ICT.
Otros factores de riesgo para el vasoespasmo son la edad menor de 50 años, hiperglucemia, hipovolemia, compliaciones de la cirugía de aneurisma, bajo grado de Hunt&Hess o Glasgow < 14. Pacientes que toman fármacos ISRS o expuesto a estatinas podrían tener mayor riesgo de vasoespasmo (estudios restrospectivos). A pesar de ello, la American Stroke Society admite el uso de estatinas para la prevención del vasoespasmo, prevastatina 40mg o simvastatina 80mg /24h.
La monitorización mediante Doppler transcraneal puede se una técnica efectiva para diagnósticar el vasoespasmo, pero al ser operador dependiente (más operador dependiente que otras pruebas) y su baja S y E, hacen que se recurra al angio-TC (DSA) para su diagnóstico. También podrían usarse RM-perfusión.
La prevención del vasoespasmo es importante, porque el tratamiento puede ser complicado. De este modo, hay que monitorizar la TA y la volemia, además de que todos los paciente deberían tomar Nimpodipino 60 mg/4h/21dias oral o por sonda nasográstica, ya que su administración intravenosa se ha asociado con graves efectos secundarios, inclusive la muerte. Las estatinas están también están indicadas.
Una vez establecido el vasoespasmo, su tratamiento ha de ser intensivo mediante Incremento Hemodinámico: Euvolemia mediante cristaloides o solución coloidal, inducir hipertensión mediante vasopresores como la Fenilefrina, Norepinefrina o Dobutamina. En pacientes que no responden, la dobutamina y milrinona han demostrdo beneficios. Los pacientes no responden al sostén hemodinámico, pueden tratarse con Angioplastia con balón o mediante la administración intraarterial de vasodilatadores.



Hidrocefalia: Es muy común y puede darse temprana o tardía. Se diagnostica por TC en un paciente con deterioro neurológico que ha sufrido una HSA. Es una hidrocefalia obstructiva comunicante por falta de absorción de líquido cefalorraquídeo por las ganulaciones aracnoideas. Requiere drenaje.
TRATAMIENTO y PRONÓSTICO:
Varía en función de la etiología subyacente, sin embargo, nombremos algunas medidas generales que pueden llevarse a cabo.
- Observación contínua: Glasgow, Temperatura, ECG, Pupilas, Focalidad, Presión intracraneal.
- Nutrición: Oral > Nasogástrica > Parenteral total.
- Fluidos y electrolitos: 3l/dia iv con monitorización diaria de electrolitos.
- Hipertensión: tratarla solo cuando se evidencien signos de afectación orgánica.
- Vasoespasmo. Incremento Hemodinámico: Hemodilución, Hipertensión, Euvolemia. Nimodipino. Intervención endovascular.
El pronóstico varia según:
- Causa de la HSA.
- Grado de Subaracnoidea.
- Co-morbilidad asociada.
Graduación del riesgo: Numerosos sistemas se han usado para estandarizar la clasificación de pacientes con HSA basánsdose en el exámen clínico incial. La escala de Hunt & Hess y lade la Federación Mundial de Neurocirujanos (WFNS) son las más usadas.
La escala modificada de Fisher es una escala de riesgo de desarrollo de isquemia cerebral tardía producido por vasoespasmo tras una HSA. No diferencia la HSA focal o difusa. A diferencia de la escala de Fisher, tiene en cuenta el riesgo sumatorio y aditivo de presentar sangre en el espacio subaracnoideo e intraventricular. Divide la HSA en “fina” y “gruesa” pero no especifica como se valora.
Se puntúa como sigue de 0 a 4 (cuanto mayor más riesgo de isquemia cerebral tardía por vasoespasmo):
0 – No HSA o hemorragia intraventricular.
1 – HSA focal o difusa fina sin hemorragia intraventricular.
2 – HSA focal o difusa fina con hemorragia intraventricular.
3 – HSA focal o difusa gruesa sin hemorragia intraventricular.
4 – HSA focal o difusa gruesa con hemorragia intraventricular
Bibliografía:
http://brain.oxfordjournals.org/content/124/2/249.full.pdf+html
http://radiopaedia.org/articles/subarachnoid-haemorrhage
http://radiopaedia.org/articles/perimesencephalic-subarachnoid-haemorrhage
http://pubs.rsna.org/doi/pdf/10.1148/radiol.11110486
http://www.scielo.br/pdf/anp/v69n6/12.pdf
http://scielo.isciii.es/scielo.php?pid=S0212-71992008000700008&script=sci_arttext
http://www.redheracles.net/media/upload/research/pdf/23044408_Guia1390308599.pdf



Deja un comentario